公司动态
【CNS前沿文献追踪】- FBXO38调节PD-1泛素化影响肿瘤免疫
发布时间:2022-11-22
PD-1单抗药已经上市,但PD-1蛋白层面的调节机制并不清楚,此次整理分享的文章研究了PD-1降解机制:内化、泛素化、蛋白酶体降解,FBXO38在PD-1降解过程中发挥重要作用,具体内容如下:

三种不同T细胞(人 CD8 T cell、小鼠CD8 T cell、Jurkat cell)PD-1表达水平-时间变化曲线:激活后的T细胞2天PD-1表达到峰值,之后开始降解

还是那三种细胞,蛋白水平看激活后2天PD-1表达开始降低,但转录层面变化不明显
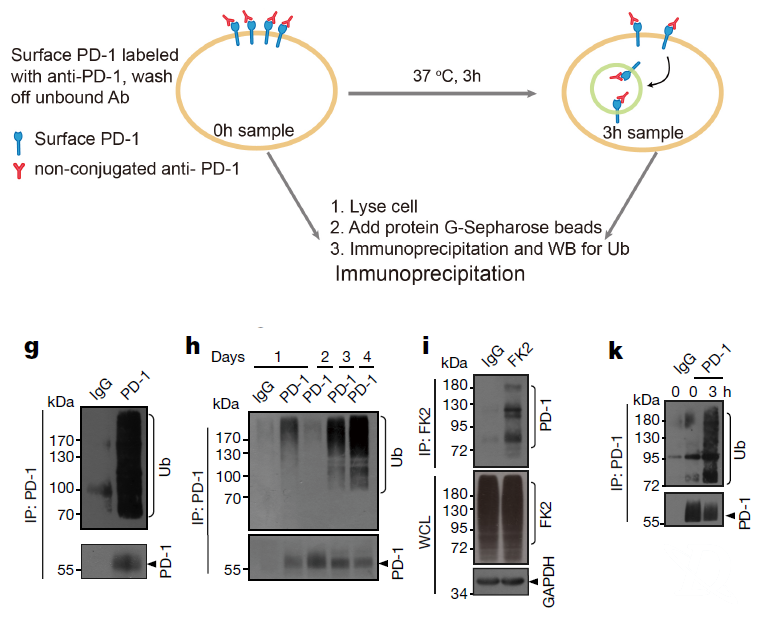
IP实验发现PD-1和泛素相互作用,暗示PD-1被泛素化

PD-1胞内段有泛素化位点(210 Lys和233 Lys),共聚焦显微镜观察到了PD-1内化、降解过程

蛋白酶体抑制剂MG132可抑制PD-1的降解,溶酶体抑制剂NH4Cl则不能,这个数据也暗示PD-1降解是由蛋白酶体参与的泛素化调节的

在Jurkat细胞上表达GST-PD-1,用PD-1“钓”蛋白(质谱表征),找调节PD-1泛素化的E3连接酶:钓到了100多个蛋白(上图只截取了部分),比对文献,其中FBXO系列蛋白属于E3泛素连接酶
 基于质谱大数据,再用IP实验验证:PD-1和FBXO38存在相互作用
基于质谱大数据,再用IP实验验证:PD-1和FBXO38存在相互作用

在细胞上表达FBXO38会降低PD-1的表达(FBXO47则无此效果,暗示FBXO38对PD-1表达调节的特异性;另外FBXO38的表达对TCR的表达不产生影响)

敲低FBXO38,PD-1表达升高(TCR表达不受影响),结合上面的数据,说明FBXO38是调节PD-1降解的E3泛素化连接酶

再次验证:只有同时表达PD-1和FBXO38才可观察到PD-1泛素化;调高FBXO38,PD-1泛素化升高,调低则泛素化降低

PD-1上233位Lys是泛素化发生位点(不是210位Lys);FBXO38上F-Box结构域对泛素化PD-1很关键;泛素上48位Lys关键,而非63位Lys(和文献报道的FBXO系列蛋白调控机理一致)

时间维度再看一下FBXO38对PD-1降解的调节

特异性的敲除T细胞上FBXO38后,T细胞的发育、稳态、记忆不受影响

特异性KO T细胞FBXO38不影响T细胞激活、增殖、凋亡,也不影响疲劳marker LAG-3的表达

KO FBXO38使T细胞(包括Treg)PD-1表达升高

敲除FBXO38的小鼠种瘤之后肿瘤生长更快、小鼠存活时间缩短

检测肿瘤浸润T细胞:敲除FBXO38并不影响T细胞对肿瘤的浸润,且不影响T细胞对肿瘤细胞的识别(CD44阳性细胞比例未发生变化)

检测肿瘤浸润T细胞:敲除FBXO38后,CD4和CD8 T细胞PD-1表达升高(Treg细胞PD-1表达无差异),效应分子(颗粒酶、干扰素、肿瘤坏死因子)阳性CD8 T细胞比例降低,CD8 T细胞增殖能力降低

PD-1抗体抑瘤作用可在FBXO38细胞缺陷的小鼠上发挥,作用和野生型小鼠没有差异

前面的数据说明了FBXO38对PD-1的调节作用,初步研究了FBXO38对于肿瘤免疫的调节作用,进一步研究FBXO38对肿瘤免疫的调节作用:用RNAi技术敲低FBXO38,敲低后TCR和CD28的表达不受影响

FBXO38被敲低后,CD8 T细胞的激活、细胞因子生成不受影响

In vitro:FBXO38被敲低后PD-1表达升高,CTL杀伤肿瘤细胞的能力减弱,PD-1抗体可rescue FBXO38敲低引起的杀伤能力减弱

In vivo看FBXO38敲低对肿瘤免疫的影响:敲低后CD8 T抑瘤作用减弱,PD-1抗体可rescue

小鼠模型上说明还不够,检测肿瘤病人样品:肿瘤部位的FBXO38 mRNA水平更低,与PD-1表达水平负相关

CD3抗体激活小鼠T细胞后,FBXO38表达降低

CD3和CD28抗体同时激活T细胞后,FBXO38的转录先下降后期升高

除CD3、CD28抗体激活外,在加入IL-2可进一步提高FBXO38的表达

其他细胞因子不具有IL-2促进FBXO38转录的作用

ChIP发现IL-22能促进STAT5(IL2的下游)结合到FBXO38的Enhancer和Promoter上 – 弄清了IL-2促进FBXO38转录的机制

In vivo验证IL-2的作用:IL可通过促进FBXO38的转录,抑制PD-1的表达,进而抑制肿瘤的生长

还是那三种细胞,蛋白水平看激活后2天PD-1表达开始降低,但转录层面变化不明显

IP实验发现PD-1和泛素相互作用,暗示PD-1被泛素化

PD-1胞内段有泛素化位点(210 Lys和233 Lys),共聚焦显微镜观察到了PD-1内化、降解过程

蛋白酶体抑制剂MG132可抑制PD-1的降解,溶酶体抑制剂NH4Cl则不能,这个数据也暗示PD-1降解是由蛋白酶体参与的泛素化调节的

在Jurkat细胞上表达GST-PD-1,用PD-1“钓”蛋白(质谱表征),找调节PD-1泛素化的E3连接酶:钓到了100多个蛋白(上图只截取了部分),比对文献,其中FBXO系列蛋白属于E3泛素连接酶
 基于质谱大数据,再用IP实验验证:PD-1和FBXO38存在相互作用
基于质谱大数据,再用IP实验验证:PD-1和FBXO38存在相互作用
在细胞上表达FBXO38会降低PD-1的表达(FBXO47则无此效果,暗示FBXO38对PD-1表达调节的特异性;另外FBXO38的表达对TCR的表达不产生影响)

敲低FBXO38,PD-1表达升高(TCR表达不受影响),结合上面的数据,说明FBXO38是调节PD-1降解的E3泛素化连接酶

再次验证:只有同时表达PD-1和FBXO38才可观察到PD-1泛素化;调高FBXO38,PD-1泛素化升高,调低则泛素化降低

PD-1上233位Lys是泛素化发生位点(不是210位Lys);FBXO38上F-Box结构域对泛素化PD-1很关键;泛素上48位Lys关键,而非63位Lys(和文献报道的FBXO系列蛋白调控机理一致)

时间维度再看一下FBXO38对PD-1降解的调节

特异性的敲除T细胞上FBXO38后,T细胞的发育、稳态、记忆不受影响

特异性KO T细胞FBXO38不影响T细胞激活、增殖、凋亡,也不影响疲劳marker LAG-3的表达

KO FBXO38使T细胞(包括Treg)PD-1表达升高

敲除FBXO38的小鼠种瘤之后肿瘤生长更快、小鼠存活时间缩短

检测肿瘤浸润T细胞:敲除FBXO38并不影响T细胞对肿瘤的浸润,且不影响T细胞对肿瘤细胞的识别(CD44阳性细胞比例未发生变化)

检测肿瘤浸润T细胞:敲除FBXO38后,CD4和CD8 T细胞PD-1表达升高(Treg细胞PD-1表达无差异),效应分子(颗粒酶、干扰素、肿瘤坏死因子)阳性CD8 T细胞比例降低,CD8 T细胞增殖能力降低

PD-1抗体抑瘤作用可在FBXO38细胞缺陷的小鼠上发挥,作用和野生型小鼠没有差异

前面的数据说明了FBXO38对PD-1的调节作用,初步研究了FBXO38对于肿瘤免疫的调节作用,进一步研究FBXO38对肿瘤免疫的调节作用:用RNAi技术敲低FBXO38,敲低后TCR和CD28的表达不受影响

FBXO38被敲低后,CD8 T细胞的激活、细胞因子生成不受影响

In vitro:FBXO38被敲低后PD-1表达升高,CTL杀伤肿瘤细胞的能力减弱,PD-1抗体可rescue FBXO38敲低引起的杀伤能力减弱

In vivo看FBXO38敲低对肿瘤免疫的影响:敲低后CD8 T抑瘤作用减弱,PD-1抗体可rescue

小鼠模型上说明还不够,检测肿瘤病人样品:肿瘤部位的FBXO38 mRNA水平更低,与PD-1表达水平负相关

CD3抗体激活小鼠T细胞后,FBXO38表达降低

CD3和CD28抗体同时激活T细胞后,FBXO38的转录先下降后期升高

除CD3、CD28抗体激活外,在加入IL-2可进一步提高FBXO38的表达

其他细胞因子不具有IL-2促进FBXO38转录的作用

ChIP发现IL-22能促进STAT5(IL2的下游)结合到FBXO38的Enhancer和Promoter上 – 弄清了IL-2促进FBXO38转录的机制

In vivo验证IL-2的作用:IL可通过促进FBXO38的转录,抑制PD-1的表达,进而抑制肿瘤的生长
文章将分子生物学的套路搬到肿瘤免疫,从时间维度出发,观察PD-1的变化曲线,通过IP这一经典技术结合质谱大数据钓到了FBXO38,而后将其KO或KD ,看FBXO38对肿瘤免疫的作用。生命体的一切行为都有其分子基础,理清分子间的逻辑关系,再解出每种分子的晶体结构我们就可以精确的设计新的分子干预生命活动了……
Xiangbo Meng, Xiwei Liu, Xingdong Guo, Shutan Jiang, Tingting Chen, et al. FBXO38 mediates PD-1 ubiquitination and regulates anti-tumour immunity of T cells.[J] .Nature, 2018.
想了解更多CNS级期刊内容,请关注我们的公众号,常有更新哦,也可加笔者微信交流:qianle522568!

Xiangbo Meng, Xiwei Liu, Xingdong Guo, Shutan Jiang, Tingting Chen, et al. FBXO38 mediates PD-1 ubiquitination and regulates anti-tumour immunity of T cells.[J] .Nature, 2018.
想了解更多CNS级期刊内容,请关注我们的公众号,常有更新哦,也可加笔者微信交流:qianle522568!

 制药网
制药网